São as propriedades da matéria observadas em qualquer corpo, independente da substância de que ele é feito.
Extensão: Propriedade que a matéria tem de ocupar um lugar no espaço. O volume mede a extensão de um corpo.

O espaço da estante ficou totalmente preenchido pelos livros.
Inércia: propriedade que a matéria tem em permanecer na situação em que se encontra, seja em movimento, seja em repouso. Quanto maior for a massa de um corpo, mais difícil alterar seu movimento, e maior a inércia. A massa mede a inércia de um corpo.

Fotografia estroboscópica de motorista durante a parada de um carro. Com uma série de instantâneos em intervalos sucessivos de tempo, permite o estudo detalhado do movimento do corpo. Observe a movimentação do motorista e a ação do cinto de segurança.
Impenetrabilidade: Dois corpos não podem ocupar, simultaneamente o esmo lugar no espaço.
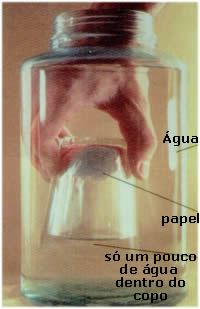
Divisibilidade: Propriedade que a matéria tem se reduzir-se em partículas extremamente pequenas.

Divisibilidade da matéria
Gráfico de Mudança de Estado Físico

Os três estados físicos ou de agregação da água são: sólido, líquido e gasoso
A temperatura em que a substância passa do estado sólido para o líquido é chamada de ponto de fusão (PF). O inverso é a solidificação.
No ponto de fusão veremos que os estados sólido e líquido coexistem. Isso significa que a temperatura do gelo não aumentará; permanecerá fixa em 0°C, até que todo ele passe para o estado líquido.
Se continuarmos aumentando a temperatura, o líquido irá se aquecer e, ao chegar à temperatura de 100°C (ao nível do mar), ocorrerá a passagem do estado líquido para o gasoso. A água passará a ser vapor; por isso, o nome dessa transformação de estado de agregação da matéria é vaporização.
Obtenção do sal de cozinha
O sal grosso é obtido pela evaporação da água do mar e purificação por cristalização. Já o sal comum é bastante purificado e são colocados aditivos
O sal de cozinha que utilizamos normalmente como tempero de vários alimentos é o cloreto de sódio, formado pela ligação iônica entre o sódio e o cloro. O sódio metálico doa um elétron para o cloro, formando o cátion sódio (Na+) e o ânion cloreto (Cl-). Esse tipo de ligação envolve na realidade um número muito grande de átomos, de modo que, no final, forma-se um aglomerado de íons, que se arrumam de forma geométrica bem definida em retículos cristalinos, como o mostrado a seguir:
.jpg)
O sal desempenhou um importante papel na situação socioeconômica mundial. Provavelmente, o hábito de utilização desse composto como tempero de comidas está ligado à passagem da vida nômade para agrícola. Os nômades possuíam rebanhos, como o teor de sal na carne desses animais é preservado, eles não necessitavam de colocar sal na comida. Mas, os que comiam mais vegetais, cereais e carnes cozidas, precisavam de um suplemento a mais de sal.
Inicialmente, ele era considerado um artigo de luxo, até mesmo guerras foram realizadas por causa de sua posse. Em algumas regiões da África Ocidental, o sal ainda continua sendo disponível apenas para os ricos.
Um aspecto interessante é que nos tempos imperiais, os exércitos romanos pagavam seus soldados com um saquinho de sal, que era chamado de salarium e que, com o tempo, foi convertido num certo valor em moedas. Foi daí que surgiu o termo “salário” que usamos até hoje para designar o pagamento do empregador ao empregado.
Atualmente, o sal é o maior bem de consumo mineral industrial no mundo. O Brasil produz sal no Rio de Janeiro, Ceará, Maranhão, Sergipe, Bahia e no Rio Grande do Norte. Este último é o maior produtor nacional, representando cerca de 95% de todo o sal produzido em nosso país.
Existem duas formas básicas de obtenção do sal de cozinha, sendo que, no mundo todo, a principal fonte é o sal de rocha, cujas jazidas são mineradas. Geralmente, ele é extraído por meio de sua dissolução em água. Essa técnica é especialmente empregada nos Estados Unidos (que é responsável por cerca de 23% da produção mundial de sal e é o maior produtor do mundo) e nos países da Europa.
Mas, em países tropicais, como o nosso, a técnica empregada para a obtenção do sal é a evaporação e cristalização da água do mar, o que corresponde a apenas 10% do sal produzido mundialmente
Separação de Misturas
Na química, a separação de misturas é muito importante, pois para obtermos resultados mais corretos em pesquisas e experiências, é necessário que as substâncias químicas utilizadas sejam as mais puras possível. Para isso, utiliza-se vários métodos de separação, que vão desde a "catação" até complicada "destilação fracionada".
Exemplos práticos onde a separação de misturas é aplicada:
- Tratamento de esgotos / Tratamento de água
O esgoto urbano contém muito lixo "grosso", é necessário separar este lixo do resto da água (ainda suja, por componentes líquidos, que serão extraídos depois)
- Dessalinização da água do mar
Em alguns lugares do planeta, a falta de água é tamanha, que é preciso pegar água do mar para utilizar domesticamente. Para isso, as usinas dessalinizadoras utilizam a osmose e membranas semi-permeáveis para purificar a água.
- Destilação da cachaça
- Separação de frutas podres das boas em cooperativas (catação)
- Exame de sangue
Separa-se o sangue puro do plasma (líquido que compõe parte do sangue, que ajuda no carregamento de substâncias pelo organismo), através de um processo de sedimentação "acelerada" (o sangue é posto em uma centrífuga, para que a parte pesada do composto se deposite no fundo do recipiente).
Tipos de misturas
Separação de misturas
Exemplos práticos onde a separação de misturas é aplicada:
- Tratamento de esgotos / Tratamento de água
O esgoto urbano contém muito lixo "grosso", é necessário separar este lixo do resto da água (ainda suja, por componentes líquidos, que serão extraídos depois)
- Dessalinização da água do mar
Em alguns lugares do planeta, a falta de água é tamanha, que é preciso pegar água do mar para utilizar domesticamente. Para isso, as usinas dessalinizadoras utilizam a osmose e membranas semi-permeáveis para purificar a água.
- Destilação da cachaça
- Separação de frutas podres das boas em cooperativas (catação)
Tipos de misturas
Mistura é uma associação de duas ou mais substâncias diferentes. A maioria dos materiais encontrados na natureza não são substâncias puras, e sim misturas de mais de um tipo de molécula na sua constituição. As espécies químicas presentes na mistura são denominadas componentes.
Cada aspecto distinto observado na região de um sistema é chamado de fase. De acordo com o número de fases e também com a observação visual, podemos classificar as misturas como homogêneas ou heterogêneas.
Cada aspecto distinto observado na região de um sistema chamamos de fase. Usamos o método de observação visual para classificar as misturas e, de acordo com o número de fases que elas apresentam, podem ser classificadas em homogêneas ou heterogêneas.
Misturas Homogêneas: são aquelas que apresentam uma única fase, ou seja, são monofásicas. Toda sua extensão possui um único aspecto.
A mistura homogênea pode ser chamada também de solução. Alguns exemplos são as misturas da água com álcool, água com açúcar e o ar atmosférico.
Misturas Heterogênea
 Água e óleo formam mistura heterogênea
são aquelas que apresentam duas ou mais fases. Seus componentes podem ser distinguidos através da observação visual, olho nu ou através de um microscópio.
Água e óleo formam mistura heterogênea
são aquelas que apresentam duas ou mais fases. Seus componentes podem ser distinguidos através da observação visual, olho nu ou através de um microscópio.
De acordo com o número de fases, a mistura heterogênea pode ser classificada em: bifásica, quando apresenta duas fases; trifásica, quando apresenta três fases; polifásicas, quando apresenta a partir de quatro fases. Água e areia ou água e azeite são alguns exemplos de misturas heterogêneas.
Cada aspecto distinto observado na região de um sistema é chamado de fase. De acordo com o número de fases e também com a observação visual, podemos classificar as misturas como homogêneas ou heterogêneas.
Cada aspecto distinto observado na região de um sistema chamamos de fase. Usamos o método de observação visual para classificar as misturas e, de acordo com o número de fases que elas apresentam, podem ser classificadas em homogêneas ou heterogêneas.
Misturas Homogêneas: são aquelas que apresentam uma única fase, ou seja, são monofásicas. Toda sua extensão possui um único aspecto.
A mistura homogênea pode ser chamada também de solução. Alguns exemplos são as misturas da água com álcool, água com açúcar e o ar atmosférico.
Misturas Heterogênea
 Água e óleo formam mistura heterogênea
Água e óleo formam mistura heterogênea De acordo com o número de fases, a mistura heterogênea pode ser classificada em: bifásica, quando apresenta duas fases; trifásica, quando apresenta três fases; polifásicas, quando apresenta a partir de quatro fases. Água e areia ou água e azeite são alguns exemplos de misturas heterogêneas.
Separação de misturas
Quando desejamos separar os componentes de uma mistura devemos usar processos específicos que são definidos de acordo com alguns fatores, como:
- O tipo de mistura: homogênea ou heterogênea.
- Seu estado físico: sólido, líquido ou gasoso.
- As propriedades físicas dos materiais que constituem a mistura: pontos de fusão e ebulição, densidade e solubilidade.
I)Separação dos componentes de mistura homogênea
Destilação Simples: a separação ocorre de acordo com a diferença nos pontos de ebulição do solvente e soluto. Por aquecimento, em aparelhagem apropriada com um condensador adaptado, só o líquido entra em ebulição, passando para o estado gasoso, e, em seguida, é condensado e recolhido, separando-se do sólido.
Para separar a mistura de água e sal e recuperar também a água, emprega-se a destilação simples. O líquido purificado, que é recolhido no processo de destilação, recebe o nome de destilado.
Evaporação: neste processo a mistura, contida em recipiente aberto, é aquecida (naturalmente ou não) até o líquido evaporar, separando-se do soluto na forma sólida. Este é o método utilizado nas salinas para obtenção de sal marinho.
Destilação fracionada: consiste no aquecimento dos líquidos misturados, em aparelhagem específica e com controle de temperatura. Dessa forma, à medida que a temperatura for aumentando, o ponto de ebulição específico de cada líquido é atingido, fazendo com que cada um deles deixe a mistura isoladamente. O componente mais volátil, ou seja, aquele com menor ponto de ebulição, é destilado primeiro. Este processo é utilizado, por exemplo, na obtenção de bebidas alcoólicas, e também no fracionamento do petróleo para a obtenção de seus subprodutos.
Liquefação fracionada: através de resfriamento em aparelhagem adequada e com controle de temperatura, os gases se liquefazem separadamente. Uma aplicação desse processo consiste na separação dos componentes do ar atmosférico.
II)Separação dos componentes de mistura heterogênea
Decantação: este processo é utilizado quando o componente sólido for mais denso que o líquido da mistura. Essa diferença de densidade faz com que o sólido se deposite no fundo do recipiente, e, após a deposição, inclina-se o recipiente para escoar o líquido.
Centrifugação: processo caracterizado pelo uso de aparelhos denominados centrífugas, que aceleram a decantação, separando materiais de densidades diferentes. A separação de glóbulos vermelhos do plasma sanguíneo é feito com o auxílio de uma centrífuga.
Educação: Processo de tratamento da água envolve filtração, veja!
Filtração: a mistura é separada através de uma superfície porosa que, dependendo do tamanho da partícula sólida a ser isolada, pode ser de cascalho, areia, tecido ou carvão ativado. O sólido fica retido no filtro e o líquido é recolhido em outro recipiente. A preparação do café é um exemplo de filtração.
- O tipo de mistura: homogênea ou heterogênea.
- Seu estado físico: sólido, líquido ou gasoso.
- As propriedades físicas dos materiais que constituem a mistura: pontos de fusão e ebulição, densidade e solubilidade.
| Líquido + Sólido |
Para separar a mistura de água e sal e recuperar também a água, emprega-se a destilação simples. O líquido purificado, que é recolhido no processo de destilação, recebe o nome de destilado.
Evaporação: neste processo a mistura, contida em recipiente aberto, é aquecida (naturalmente ou não) até o líquido evaporar, separando-se do soluto na forma sólida. Este é o método utilizado nas salinas para obtenção de sal marinho.
| Líquido + Líquido |
| Gás + Gás |
II)Separação dos componentes de mistura heterogênea
| Líquido + Sólido |
Centrifugação: processo caracterizado pelo uso de aparelhos denominados centrífugas, que aceleram a decantação, separando materiais de densidades diferentes. A separação de glóbulos vermelhos do plasma sanguíneo é feito com o auxílio de uma centrífuga.
Educação: Processo de tratamento da água envolve filtração, veja!
Filtração: a mistura é separada através de uma superfície porosa que, dependendo do tamanho da partícula sólida a ser isolada, pode ser de cascalho, areia, tecido ou carvão ativado. O sólido fica retido no filtro e o líquido é recolhido em outro recipiente. A preparação do café é um exemplo de filtração.
